CAR-T疗法已成为癌症免疫治疗的重要支柱之一。自2017年美国FDA批准全球首款CAR-T疗法上市以来,已有4款CD19 CAR-T产品和1款BCMA CAR-T产品获批,累计适应证包括急性淋巴细胞白血病、弥漫性大B细胞淋巴瘤、原发纵隔B细胞淋巴瘤、套细胞淋巴瘤、滤泡性淋巴瘤和多发性骨髓瘤。
不过,尽管CAR-T疗法为血癌治疗带来了革命性的突破,但大量接受CD19或CD22单靶向CAR-T细胞疗法(monoCAR-T cell therapy)治疗的白血病和淋巴瘤患者会由于抗原丢失或下调而病情复发。
为了解决肿瘤抗原逃逸,克服这种耐药性,很多科学家团队开始尝试开发同时靶向多个肿瘤抗原的多特性CAR-T细胞疗法。其中,双靶点CAR-T的开发在近几年已经取得了不错的进展。例如,去年在复发B细胞恶性肿瘤患者中调查CD19xCD20 CAR-T细胞疗法的首个I期试验结果显示,所有12例接受高剂量、新鲜生产的双特异性CAR-T细胞治疗的患者全部有响应(第28天ORR为100%,CRR达92%)[1]。此外,多款CD19xCD22 CAR-T疗法的临床数据显示,这类双靶点CAR-T总体来说安全性比单靶点要好,ORR在70%-100%之间。

来源:Blood
在双靶点CAR-T细胞疗法取得积极成果的同时,一些研究者也在开发同时靶向三种肿瘤抗原的CAR-T细胞疗法。该领域较早的一篇文献于2017年发表在Blood杂志上[2]。来自贝勒医学院的一个研究团队报道了同时靶向CD19、CD20 以及CD22的三特异性CAR-T疗法。
在该研究中,科学家们设计了两种三特异性CAR-T细胞产品。一种是使T细胞表面分别表达三个独立的CAR(TriCAR),这些CAR的胞外域分别来自靶向CD19、CD20和CD22的单链可变片段(ScFv);另一种产品使T细胞表达一个靶向CD19的CAR,以及一个靶向CD20和CD22的双特异性CAR(SideCAR)。所有CAR都与胞内信号域——共刺激分子4-1BB以及T细胞受体ζ链融合(属于二代CAR)。
利用CD19逃逸模型(CD19阴性复发骨髓样本以及用CRISPR敲除CD19的原发性ALL样本),研究测试了TriCAR和SideCAR-T的有效性,结果显示,三价CAR-T细胞有效降低了CD19阴性复发,可生产IFN-γ和TNF-α,杀死CD19阴性原发性ALL,相比之下,CD19单靶向CAR-T细胞对这些模型无效。
研究者们认为,这些结果表明,三价CAR-T细胞可以有效靶向具有不同抗原谱的原代ALL细胞,并缓解CD19阴性复发。该策略有潜力作为CD19阴性疾病复发患者的挽救性治疗,以及原发性ALL的前线治疗。

来源:Science Translational Medicine
3月24日,发表在Science Translational Medicine杂志上的一项研究中,来自Miltenyi Biotec子公司Lentigen的一个科学家团队报道了三特异性CAR-T疗法研发方面的一项最新进展[3]。该研究证实,同时靶向CD19、CD20和CD22的三特异性duoCAR-T细胞疗法在体外能够有效杀死抗原异质性肿瘤细胞混合物。此外,在小鼠模型中,三特异性duoCAR-T细胞疗法也成功控制了抗原异质性肿瘤的负担。
具体来说,在该研究中,为了克服B细胞肿瘤抗原逃逸,科学家们利用编码两种CAR开放阅读框的慢病毒载体设计了三特异性duoCAR-T细胞。duoCARs由一种“串联CD19 binder (scFv)和CD20 binder(scFv)的CAR通过P2A自裂解肽连接到另一种靶向CD22的CAR上组成。研究评估了多种细胞内T细胞信号传导基序组合,最有效的duoCAR结构包含ICOS、OX40或CD27共刺激域,而不是CD28或4-1BB。
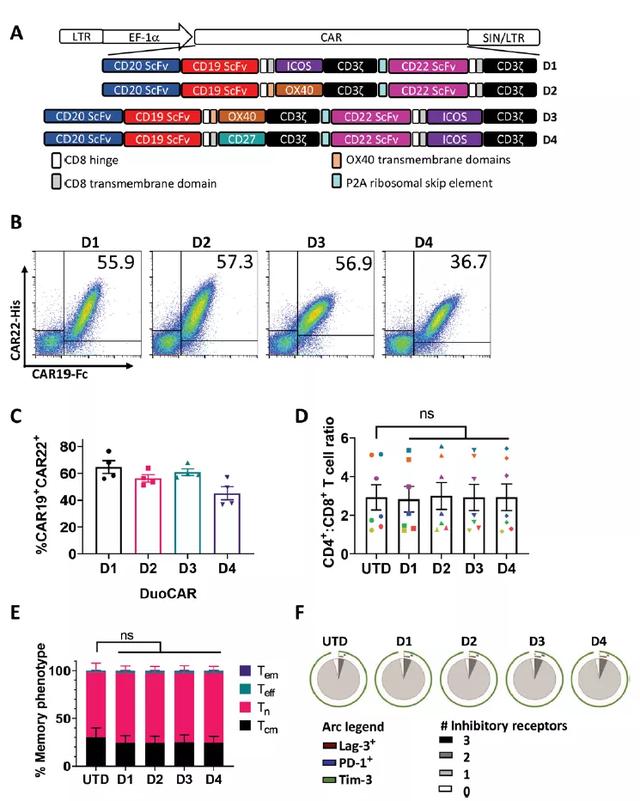
DuoCARs D1、D2、 D3和D4的设计、表达和特征(来源:Science Translational Medicine)
在确定4种最佳的binder和信号域组合后(如上图A:D1、D2、 D3和D4),研究者们开始评估duoCAR-T细胞的功能。抗原阳性细胞系Raji淋巴瘤(CD19+CD20+CD22+)和REH B-ALL (CD19+CD20−CD22+)被用来测试duoCAR-T细胞以抗原特异性方式溶解肿瘤细胞的能力。结果显示,duoCAR-T细胞与单CAR-T细胞一样,以剂量依赖的方式裂解靶点阳性(target-positive)肿瘤细胞系。
接着,研究者们继续调查duoCAR-T细胞在体内的疗效。他们在Raji非霍奇金淋巴瘤(NHL)异种移植模型和NALM-6急性淋巴细胞白血病(ALL)模型测试了DuoCARs,这两种肿瘤细胞均是CD19+CD20+CD22+三阳性,肿瘤细胞和CAR-T细胞都是通过尾静脉注射。结果显示,DuoCAR-T细胞可在体内清除弥漫性CD19+CD20+CD22+Raji和NALM-6肿瘤。
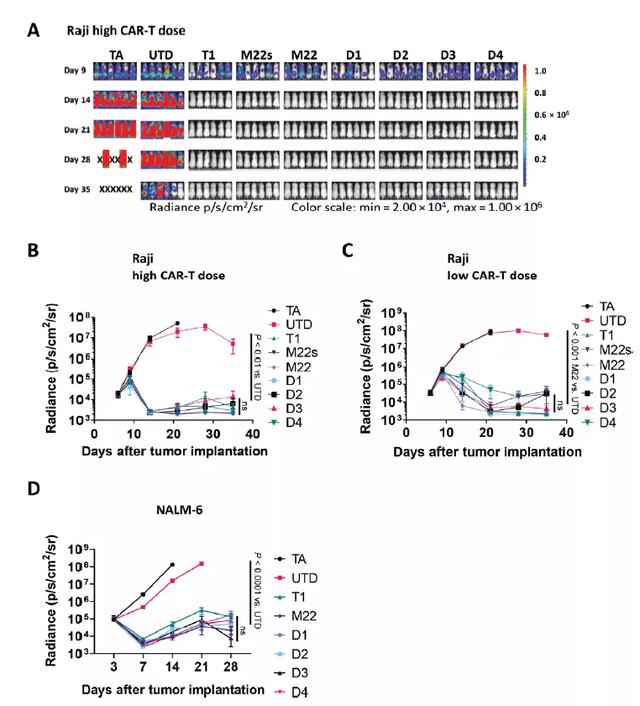
DuoCAR-T细胞在淋巴瘤和白血病的异种移植模型中根除了B细胞肿瘤(来源:Science Translational Medicine)
在证明duoCARs能够在体内介导CD19+CD20+CD22+NALM-6和Raji肿瘤的排斥反应后,研究人员继续调查了是否单个抗原也能触发duoCAR-T细胞的激活。他们将过表达CD19、CD20或CD22其中一种抗原的A431肿瘤细胞系克隆,以及基因敲除了CD19、CD20 或 CD22后只表达其它两种抗原的Raji克隆,与 duoCAR-T共培养。结果证实,表达最优duoCAR的原代人类T细胞在面对只表达CD19、CD20 或 CD22其中一种抗原的细胞,和三种抗原中其中一种为阴性(CD19阴性、CD20阴性或CD22阴性)的淋巴瘤细胞系中,均显示出了强大的抗肿瘤反应。
知识卡:CD19、CD20和CD22均为B细胞抗原。A431鳞状细胞癌细胞系天然缺乏B细胞表面分子的表达。该研究通过基因工程手段,使A431细胞系稳定表达CD19、CD20或CD22其中一种抗原。表达CD19单抗原的A431细胞克隆被定义为A19,表达CD20单抗原的A431细胞克隆被定义为A20,表达CD22单抗原的A431细胞克隆被定义为A22。结果显示,所有四种duoCAR-T细胞都能有效裂解A19、A20和A22靶细胞。
此外,为了检测duoCAR-T细胞对抗原丢失型肿瘤细胞的抗肿瘤功能,科学家们将Raji19KO细胞(敲除CD19的Raji细胞)、Raji20KO细胞、Raji22KO细胞和亲代Raji细胞(各占25%)的混合物植入NSG小鼠。这种Raji细胞克隆代表了一种靶点异质性(target-heterogeneous)肿瘤,在这类肿瘤中,一些肿瘤细胞会失去了某个靶抗原的表达,从而阻止了相应的CAR-T细胞的激活。在研究的第14天,研究者们发现所有的duoCAR-T细胞都能有效排斥异质性Raji肿瘤,且在研究结束时duoCAR-T细胞治疗依然使小鼠维持在缓解状态。相比之下,单靶向CAR(monoCAR)-T细胞都未能阻止肿瘤进展。
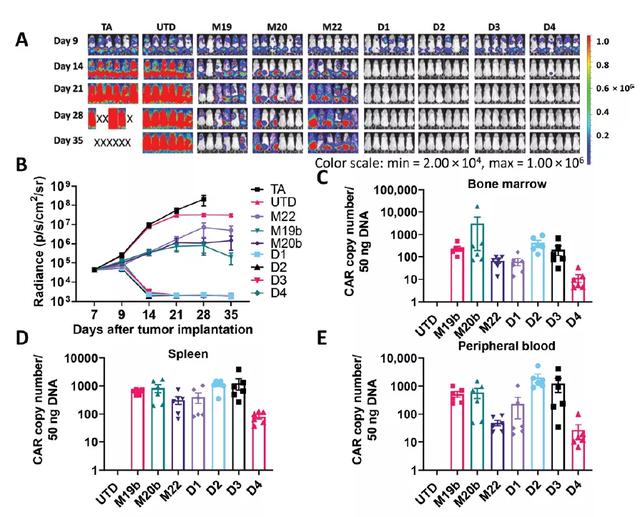
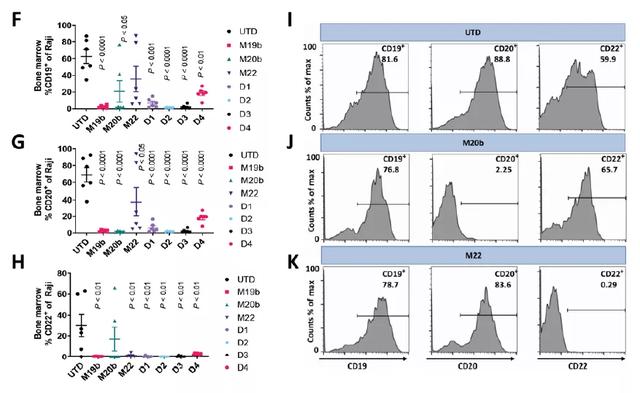
在抗原异质性的Raji肿瘤模型中,duoCARs的体内抗肿瘤活性和持久性(来源:Science Translational Medicine)
总结来说,这些结果表明,对于B细胞恶性肿瘤患者来说,多特异性duoCAR-T细胞可能是防止抗原丢失介导复发或靶抗原下调的一种非常有前途的策略。此外,研究也表明,三特异性靶向策略有望解决治疗抗原异质性癌症所面临的挑战。
专 家 点 评
优卡迪 CEO 俞磊博士

- 突破之处与潜在挑战
发表在Science Translational Medicine上的这项新成果报道了一款三特异性CAR-T疗法,该产品可以同时靶向CD19、CD20和CD22,且在临床前研究中表现出极好的抗肿瘤活性。文章所介绍的具有识别三个不同抗原的三靶-CAR设计是在已有双靶-CAR基础上进一步的拓展,其优势在于可以同时应答三种不同的细胞表面抗原,具有潜在克服因肿瘤异质性或抗原逃逸而造成的“复发”的几率。但这种设计也存在潜在的挑战性,包括1)三个scFv靶向分子的空间结构的互相干扰,和2)同一个产品“脱靶”几率的增加,造成增加了因“脱靶”而出现的临床副作用发生率的增加和严重性不确定性。
该研究小组同时对比使用了多款CAR载体分子,包括Single CAR、Tandem CAR、duoCAR,还进行了不同共刺激域组合研究,用到的共刺激域分子有4-1BB、ICOS、OX40、CD27、CD28。对比后发现,最有效的CAR结构包含ICOS、OX40或CD27信号结构域,而不是CD28或4-1BB信号结构域。最终该研究小组确定了四种最佳duoCAR元件组合,对于负荷抗原异质性淋巴瘤细胞的小鼠,duoCAR-T细胞表现出良好的抗肿瘤活性。该项研究为如何来克服肿瘤抗原丢失引起的CAR-T治疗后短期复发问题展现了一个潜在的新解决思路,但从另一个角度看,这样的设计也带来了一定的局限性:三个以上靶分子(scFv)-CAR分子的基因转导、表达和保持多靶分子的靶向功能的挑战性与肿瘤异质性的多样性的矛盾。
- 三靶点CAR-T仍需验证
总体来说,三特异性CAR-T疗法无疑是在双靶-CAR-T的基础上进一步通过增加抗肿瘤抗原的靶向分子而增加了抗复发的保险。三靶向-CAR技术理论上来说可以对抗早期复发的临床问题,但目前该技术还处于临床前研发阶段,后续还有大量的工作需要去做,以进一步检验该技术的成药性,比如临床前毒性研究、产品开发工艺和质量标准研究、适应人群确定、给药剂量、给药时间等。
- 双靶点CAR-T数据积极
CD19或CD22靶向CAR-T疗法虽然可以有效改善B细胞白血病和淋巴瘤的治疗效果,但 CAR-T治疗后的短期复发问题仍是制约CAR-T技术发展的因素之一。斯隆·凯特琳纪念癌症中心(MSKCC)随访数据显示,多达50%的CAR19 T细胞治疗患者在治疗后第一年内复发,其中相当一部分表现出CD19抗原丢失。因此,单一靶点的细胞治疗模式可能会丧失治疗优势,而多靶点的CAR-T细胞治疗模式会是未来的发展趋势。
相较于刚刚起步的三特性CAR-T,业界在开发双靶点CAR-T疗法方面已经做了很多努力,且获得了一些积极进展。举例来说,在2020 ESMO大会上,Autolus Therapeutics公司公布了其靶向CD19/CD22的双靶点CAR-T疗法AUTO3的临床数据,中位随访6个月时,93%完全缓解的患者仍未出现复发。
早在2016年优卡迪就开始布局多靶点CAR-T产品,我们围绕双靶点CAR-T技术主要做了血液瘤和实体瘤两个方向的布局。在血液瘤方向,我们已建立包含CD19/CD20、CD19/CD22、CD19/CD30等多款双靶点产品在内的研发管线,这些产品目前均已经处于临床试验阶段,此外,管线还包含双靶与PDL1 Blocking技术联合的三靶向产品。在实体瘤方面,考虑到实体肿瘤抗原异质性较高,我们认为更需要通过双靶CAR设计来解决抗原异质性和抗原丢失的问题,比如HER2和MUC1双靶点联合治疗乳腺癌,HER2和IL-13Rα2双靶点联合治疗胶质瘤。
- CAR-T未来突破方向
展望未来几年,我认为, CAR-T领域需要从解决临床需求出发,在以下几个方面进行突破:1)首先是安全性,一方面需要通过对靶抗原精准性和可控性的提高,减少“脱靶”,另一方面,也要开发出针对严重CRS和ICAN的预防策略;2)第二是治疗后复发问题的改善,可通过多靶策略,深度清除肿瘤细胞,此外,也要想办法提高CAR-T细胞在体内的持久性等;3)第三是新型通用型CAR-T的技术和产品开发,努力降低基因编辑在技术层面的“脱靶”几率,获得真正达到能和自体CAR-T具有相似有效性、安全性和持续性的“通用型CAR-T”产品;4)第四是攻克实体瘤,由于肿瘤的多样性和肿瘤微环境的复杂性,联合治疗模式的开发也是未来需要突破的方向,如溶瘤病毒与CAR-T疗法结合,PD-1/CTLA-4抗体与CAR-T疗法结合和CAR-疗法与其它免疫细胞疗法的结合,如CAR-NK、CAR-M等。
本文来源:医药魔方Plus 作者:小编 免责声明:该文章版权归原作者所有,仅代表作者观点,转载目的在于传递更多信息,并不代表“医药行”认同其观点和对其真实性负责。如涉及作品内容、版权和其他问题,请在30日内与我们联系
 医药魔方Plus
医药魔方Plus


 我们沟通的很顺畅
我们沟通的很顺畅 电话已拨通,无人接听
电话已拨通,无人接听 这个电话号码是空号
这个电话号码是空号